13.TP2 : Réactifs en défaut et en excès
Compétences mises en jeu
• Modéliser, par l’écriture d’une équation de réaction, la combustion, la corrosion d’un métal par un acide, l’action d’un acide sur le calcaire.
• Identifier le réactif limitant à partir des quantités de matière des réactifs et de l'équation de réaction.
• Déterminer le réactif limitant lors d’une transformation chimique totale, à partir de l’identification des espèces chimiques présentes dans l’état final.
Matériel :
Au bureau
- ☐ Aluminium en poudre (+ spatule)
- ☐ Briquets ou allumettes
- ☐ 1,5 L de solution d'acide chlorhydrique à 1 mol/L
- ☐ Carbonate de calcium en poudre (+ spatule)
Pour les élèves
- ☐ 1 bougie chauffe-plat
- ☐ 1 grand bécher
- ☐ 4 béchers de 75 mL
- ☐ 1 balance à 0,1 g
- ☐ 1 coupelle de pesée
- ☐ 1 éprouvette de 20 ou 25 mL en verre
I - Combustion de la paraffine
Protocole et observations
🖑 Allumer une bougie et attendre quelques secondes qu'elle brille convenablement.
🖑 Poser un grand bécher à l'envers sur la table au-dessus de la bougie.
Exploitation
1 Repérer les deux transformations décrites dans ce texte, et indiquer s'il s'agit de transformations physiques ou chimiques.
2 On s'intéresse à la transformation chimique.
2.a Indiquer les espèces chimiques présentes avant et après la transformation.
2.b Préciser les réactifs, les produits et les espèces spectatrices.
2.c Écrire l'équation de la réaction chimique.
2.d Indiquer, en justifiant à partir des observations, quel est le réactif limitant.
II - Action d'un acide sur du métal
Protocole et observations
🖑 Placer environ \(\pu{0,5 g}\) de poudre de fer dans un petit.
🖑 Ajouter environ \(\pu{20 mL}\) de solution de chlorure d'hydrogène (acide chlorhydrique) à \(\pu{1 mol/L}\).
✎ Noter vos observations
✎ Proposer une série de tests qui permettraient d'identifier le gaz qui se forme.
Exploitation
1 Indiquer les espèces chimiques présentes avant et après la transformation.
2 Préciser les réactifs, les produits et les espèces spectatrices.
3 Écrire l'équation de la réaction chimique.
4 Indiquer, en justifiant à partir des observations, quel est le réactif limitant.
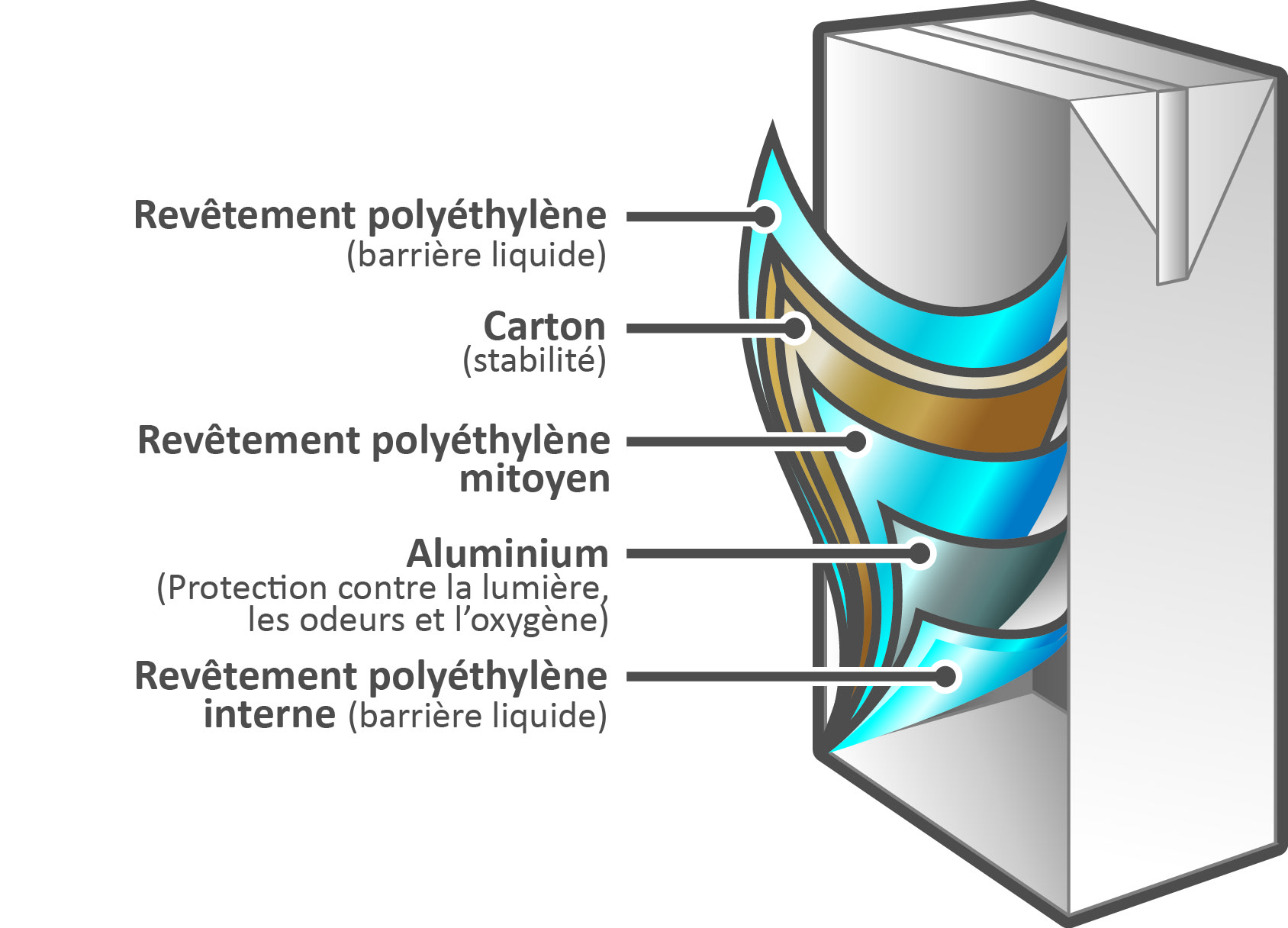
5 Expliquer pourquoi, dans les emballages alimentaires de liquides (voir ci-contre) il faut séparer la couche d'aluminium et le liquide par un film plastique.
III - Action d'un acide sur du calcaire
Protocole et observations
On dispose d'une solution de chlorure d'hydrogène (acide chlorhydrique) de concentration \(\pu{100 g·L-1}\).
🖑 Préparer les trois béchers suivants :
| Bécher 1 | Bécher 2 | Bécher 3 | |
|---|---|---|---|
| Solution de chlorure d'hydrogène | \(\pu{20 mL}\) | \(\pu{20 mL}\) | \(\pu{20 mL}\) |
| Carbonate de calcium (calcaire) | \(\pu{1,5 g}\) | \(\pu{1,0 g}\) | \(\pu{0,50 g}\) |
✎ Noter vos observations
✎ Proposer une série de tests qui permettraient d'identifier le gaz qui se forme.
Exploitation
1 Indiquer les espèces chimiques présentes avant et après la transformation.
2 Préciser les réactifs, les produits et les espèces spectatrices.
3 Écrire l'équation de la réaction chimique.
4 Indiquer, en justifiant à partir des observations, quel est le réactif limitant dans chaque tube.
Pour prolonger le raisonnement
Donnée : 1 mol de carbonate de calcium a une masse de 100 g.
1 Calculer la quantité de matière de carbonate de calcium et d'ion hydrogène dans chaque tube.
2 Indiquer, en justifiant à partir des calculs, quel est le réactif limitant dans chaque tube.
