8.A3 : Stabilité des molécules
Compétences mises en jeu
• Décrire et exploiter le schéma de Lewis d’une molécule pour justifier la stabilisation de cette entité, en référence aux gaz nobles, par rapport aux atomes isolés (Z ⩽ 18).
I - Le modèle de Lewis (prendre connaissance)
1) Préambule
Le modèle de Lewis a été proposé par Gilbert Lewis en 1916. Il a été, depuis, largement remanié et complété pour aboutir, aujourd'hui, à la théorie de la liaison de valence. Il constitue néanmoins une méthode simple pour expliquer et prévoir les associations d'atomes dans la plupart des molécules.
2) Doublets non liants d'un atome
Les électrons de valence d'un atome se répartissent en électrons célibataires et doublets non liants.
Exemples :
| Atome | Hydrogène | Carbone | Azote | Oxygène | Chlore |
|---|---|---|---|---|---|
| Nombre d'électrons de valence | 1 | 4 | 5 | 6 | 7 |
| Électrons célibataires et doublets non-liants |
3) Doublets liants d'une molécule
Dans une molécule, les liaisons résultent de la mise en commun d'électrons célibataires.
On appelle doublet liant, l'ensemble des deux électrons mis en commun par deux atomes. Le doublet liant se représente par un tiret entre les deux atomes.
On distingue : la liaison simple (constituée d'un doublet liant –), la liaison double (constituée de deux doublets liants =) et la liaison triple (constituée de trois doublets liants ≡).
4) Critère de stabilité d'une molécule
Une molécule est stable si, en comptant les doublets liants et non liants, tous ses atomes ont leur couche de valence complète. Autrement dit, une molécule est stable si tous ses atomes disposent de 4 doublets (1 seul pour l'atome d'hydrogène).
II - Représentations de Lewis de quelques molécules
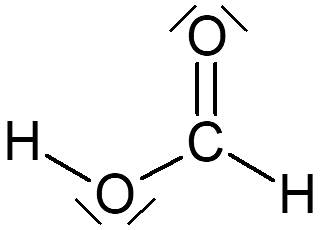
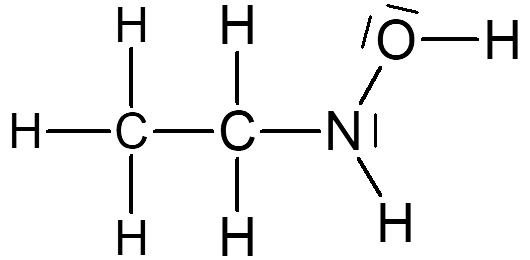
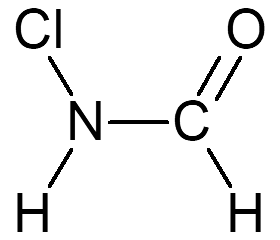
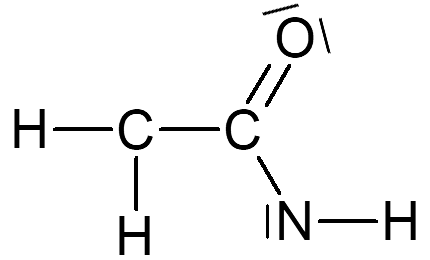
1 Surligner en rouge les doublets liants et en bleu les doublets non-liants.
2 Pour les molécules 1 et 2, vérifier que chaque atome a sa couche de valence complète.
3 Compléter la molécule 3 avec les doublets non liants.
3 Compléter la molécule 4 avec des atomes d'hydrogène pour qu'elle soit stable.
III - Constructions de molécules
1 Établir les représentations de Lewis des molécules suivantes et construire leurs modèles moléculaires.
a) Dihydrogène – Eau – Méthane CH₄ – Ammoniac NH₃
b) Chlorure d'hydrogène HCl – Propane C₃H₈ – Dioxyde de carbone
c) Diazote – Cyclohexane C₆H₁₂ – Chlorobenzène C₆H₅Cl
2 Donner les représentations de Lewis et construire les modèles moléculaires de quelques molécules de votre invention. Ces molécules doivent être stables.
