
Structure
Les atomes sont liés les uns aux autres par des liaisons très robustes.
Il n'y a pas de structure moléculaire intermédiaire.

Mise en solution
Lorsque la matière est mélangée à de l'eau, les liaisons entre les atomes ne se rompent pas.
La matière est insoluble.
Formule chimique
Fer : \(\ce{Fe}\).
Exemples similaires
Graphite : \(\ce{C}\)
Oxyde de fer : \(\ce{Fe2O3}\)

Structure
Il existe une structure intermédiaire : la molécule.
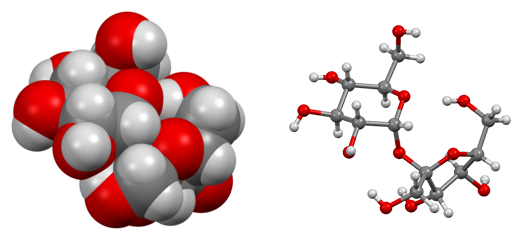
Les atomes de la molécule sont liés les uns aux autres par des liaisons très robustes.
Les molécules sont liées les unes aux autres par des liaisons moyennement robustes.
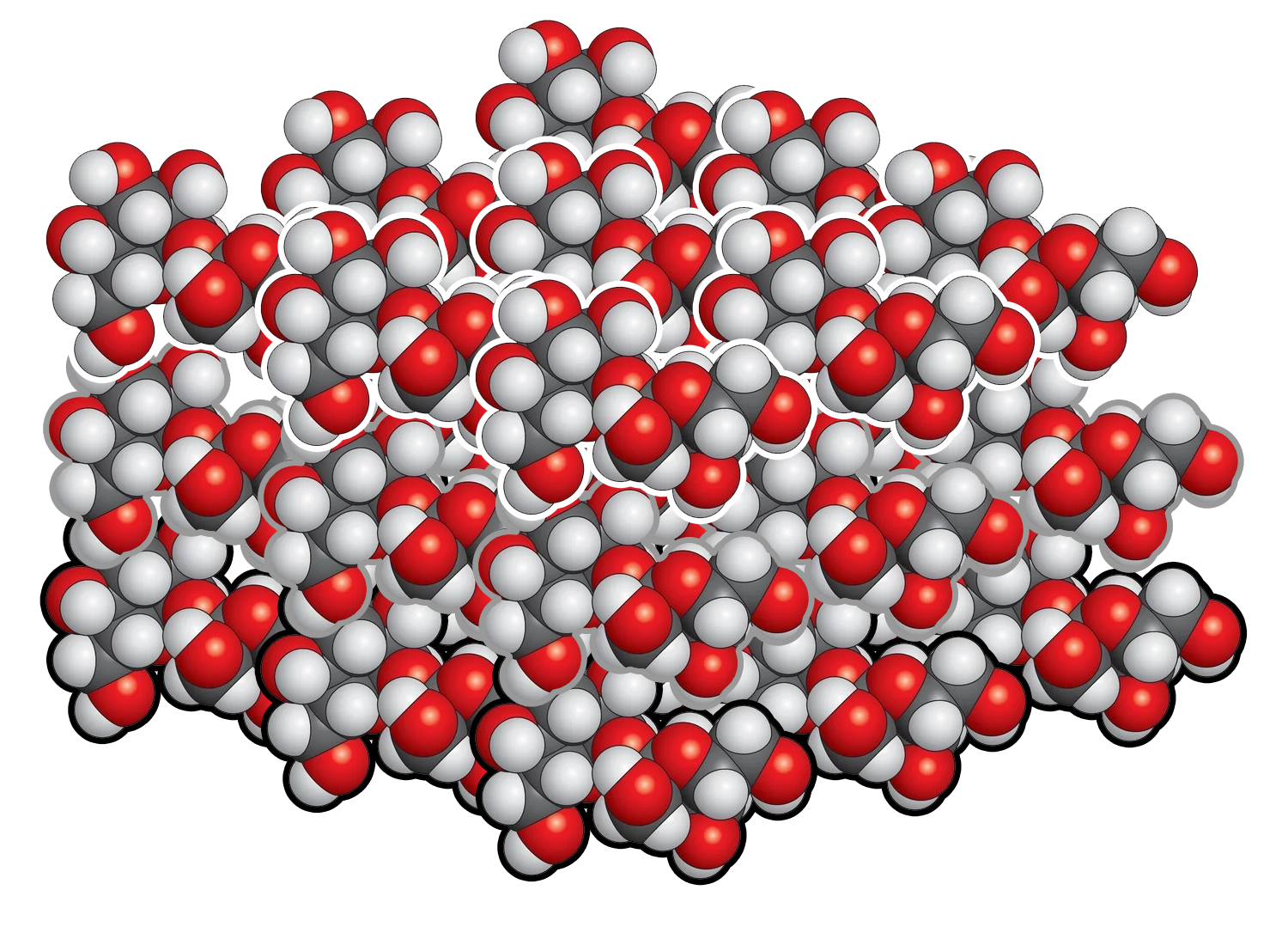
Mise en solution
Lorsque le sucre solide est mélangée à de l'eau, les liaisons entre les molécules peuvent se rompre, mais pas les liaisons entre les atomes de la molécule.
Le sucre est soluble, la dissolution donne des molécules en solution.
Formule chimique
Sucre solide : \(\ce{C12H22O11(s)}\)
Solution aqueuse de sucre : \(\ce{C12H22O11(aq)}\)
Exemples similaires
Glace (eau à l'état solide)

Structure
Les atomes sont liés les uns aux autres par des liaisons plutôt robustes.
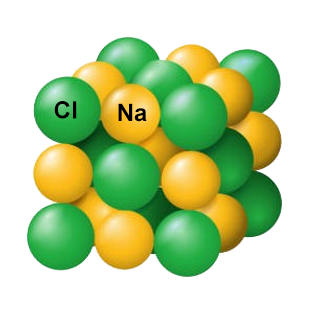
Mise en solution
L'eau parvient à rompre les liaisons entre les atomes, mais de façon dissymétrique pour les charges.

La matière est soluble, la dissolution donne des ions en solution.
Formule chimique
Sel solide : \(\ce{NaCl(s)}\)
Solution aqueuse de sel : \(\ce{Na+(aq) + Cl–(aq)}\)
Exemples similaires
Sulfate de cuivre solide : \(\ce{CuSO4(s)}\)
Solution aqueuse de sulfate de cuivre : \(\ce{Cu^2+(aq) + SO_4^2–(aq)}\)